高濃度のATPがタンパク質の異常な凝集を防ぐ ―細胞内ATPの新たな役割を発見、神経変性疾患の発症に関与する可能性―
群馬大学(群馬県前橋市)未来先端研究機構の高稲正勝助教は京都大学 今村博臣准教授、早稲田大学 吉田知史教授との共同研究により、高濃度のアデノシン三リン酸(ATP)は、細胞内タンパク質が毒性のある異常な凝集体へと変化するのを抑制していることを発見しました。タンパク質の凝集体は神経変性疾患を初めとする様々な病気の原因と考えられており、今回発見された細胞内ATPの新たな役割についての研究は、これらの疾患の発症メカニズムの解明に繋がる可能性があります。本研究の成果は英国のオープンアクセスジャーナル eLife 誌に掲載されました。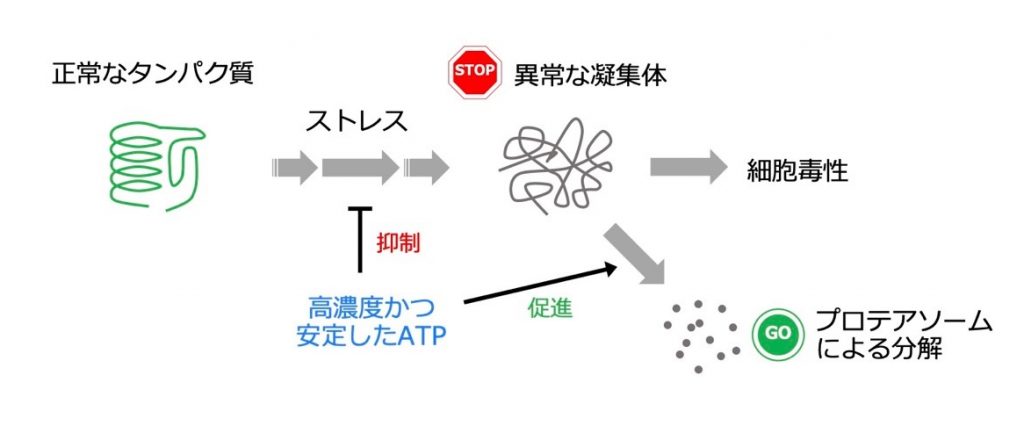
ポイント
- 細胞内ATPは必要以上に高濃度に保たれているが、その生理的意義は不明であった
- ATP濃度が不安定になり低下する遺伝子変異酵母株(ATP変異株)を初めて同定した
- ATP濃度の一過的な低下と異常なタンパク質凝集体の形成は密接に関連していた
- 安定したATP濃度はタンパク質の安定化とタンパク質凝集体の分解に重要であった
- 神経変性疾患の原因タンパク質がATP変異株内で毒性のある凝集体を形成したことから、ATP濃度低下はこれらの凝集体生成の一因であることが示唆された
研究の背景
私たちの体を構成する細胞は生存や増殖のために莫大なエネルギーを消費し続けています。ATP(注1)は細胞内の最も主要な化学エネルギー運搬体です。細胞にとって、ATPのエネルギーは使い勝手が良いため、ATPは「細胞内のエネルギー通貨」とも呼ばれます。ATPは筋肉の収縮やタンパク質分解を初めとした生体内の様々な反応に直接エネルギーを供給するエネルギー源として働くだけでなく、酵素活性制御、イオンチャネル制御および遺伝子発現制御に関するシグナル分子としても機能します。したがって細胞内ATPの動態やその制御の仕組みを理解することは、細胞のエネルギー代謝や恒常性維持機構を理解する上で重要な意義があります。
私たちの研究グループは以前から真核細胞の優れた実験モデルである出芽酵母(注2)を使用して、細胞内ATPの動態を一細胞レベルで解明することを目指して研究に取り組んできました。しかし、従来の生化学的にATPを計測する手法では細胞集団の平均のATP量しか測定できないため、単一の細胞内のATP濃度を計測することは不可能でした。そこで私たちはATPバイオセンサーと呼ばれる、ATPの量を可視化するタンパク質を酵母細胞に導入することにより、個々の細胞内でのATP濃度を高精度で観測できる実験系をこれまでに確立しました(注3)。その結果、酵母細胞内では細胞周期や栄養源とは無関係にATP濃度を常に一定に保つ仕組みがあることを発見し、これをATP恒常性と名付けました。ATP恒常性によりATP濃度は約5 mMに保たれていましたが、これは一般的な酵素が必要とするATP濃度よりもはるかに高い濃度であり、細胞がなぜこのような過剰とも言えるATPを保持しているのか、その生理的な意味は謎のままでした。またATP恒常性維持に関与する遺伝子についても不明でした。
本研究の概要
今回の研究プロジェクトにおいて、私たちはまずATP恒常性に関与する因子の探索を行い、ATP恒常性が破綻して、ATP濃度が低下する遺伝子変異酵母株(ATP変異株)をいくつか同定しました。中でもアデノシン一リン酸活性化プロテインキナーゼ(AMP-activated protein kinase、AMPK)とアデニレートキナーゼ(adenylate kinase, ADK)という2つのリン酸化酵素がATP恒常性に重要であることを発見しました。これらの酵素の遺伝子を破壊した細胞においては平均ATP濃度が低下しており、またランダムなタイミングでATP濃度が急激に低下して回復する様子が観察されました。さらに個々の酵母細胞内でATP濃度とタンパク質凝集体(注4)を同時に詳細に観察したところ、AMPKとADKの遺伝子破壊株ではATPが一過的に低下した後に、タンパク質凝集体が急激に増大し始める様子が確認されました。またパーキンソン病の原因タンパク質のひとつであるα-シヌクレインやハンチントン病の原因タンパク質と考えられているハンチンチンを酵母細胞に導入して、その毒性を評価したところ、ATP変異株においてはそれらのタンパク質の毒性が増強されました。また実際にATP変異株ではα-シヌクレインが凝集して蓄積しやすいことも確認できました。
これらの結果は細胞内ATP濃度が一過的にでも低下してしまうと、タンパク質の異常な凝集体形成を誘導する可能性があるため、細胞は常に高濃度のATPを保とうとする、というATP恒常性の生理的意義を示唆しています。高濃度のATPが実際にタンパク質凝集を抑制するメカニズムについてはまだ定かではないですが、細胞内の異常なタンパク質凝集体を分解・除去するための装置であるプロテアソームを駆動するには大量のATPを必要とすることが古くから知られています。本研究においても細胞内の異常なタンパク質凝集体を除去するのにプロテアソーム活性が重要であり、またATP変異株ではプロテアソーム活性が低下していることが示唆されました。さらに最近の研究で、試験管内において数mM程度のATPがタンパク質の溶解補助剤として直接作用して、タンパク質の熱変性と凝集を抑制することが示されています。これらの知見も総合すると、細胞内のATPを高濃度に保つことで、細胞内のプロテアソームの活性を担保すると共にタンパク質の可溶化を促進してタンパク質凝集を防いでいると推察されます。
アルツハイマー病等の神経変性疾患(注5)を初めとした多くの疾患では、タンパク質の異常な凝集体が毒性を発揮して発症要因になると考えられています。今回の研究で明らかになった、ATP恒常性の破綻による細胞内ATP濃度の変動は、これらのタンパク質凝集体が誘導する疾患の発症メカニズムの一端を説明する可能性があります。このためATP恒常性の仕組みを追求することは、私たちの細胞内での異常なタンパク質凝集体形成を抑制する薬の開発に繋がると期待されます。
論文詳細
- 雑誌名:eLife (英国)
- タイトル:High and stable ATP levels prevent aberrant intracellular protein aggregation in yeast
安定した高濃度のATPは細胞内タンパク質の異常な凝集を防ぐ - 著者:Masak Takaine1,2*, Hiromi Imamura3, Satoshi Yoshida1,2,4,5*
高稲 正勝1,2*, 今村 博臣3, 吉田 知史1,2,4,5*(1群馬大学 未来先端研究機構, 2群馬大学 生体調節研究所, 3京都大学大学院 生命科学研究科, 4早稲田大学 国際教養学部, 5さきがけ, * 共同責任著者) - 公開日:2022年4月20日(日本時間)
- 一般向けの紹介記事
本研究は生体調節研究所内分泌・代謝学共同研究拠点共同研究、日本学術振興会科学研究費補助金、武田科学振興財団医学系研究助成および科学技術振興機構の助成を受けて行われました。
関連リンク
プレスリリース
高濃度のATPがタンパク質の異常な凝集を防ぐ ―細胞内ATPの新たな役割を発見、神経変性疾患の発症に関与する可能性―
本件に関するお問合せ先
(◎を半角アットマークに変更してください。)
研究に関するお問い合わせ
群馬大学 未来先端研究機構 / 生体調節研究所 細胞シグナル分野
助教 高稲 正勝
TEL:027-220-8882
E-MAIL:masaktakaine◎gunma-u.ac.jp
報道に関するお問い合わせ
群馬大学 総務部総務課広報係
TEL:027-220-7010
FAX:027-220-7012
Email:s-public◎ml.gunma-u.ac.jp
京都大学 総務部広報課国際広報室
TEL:075-753-5729
FAX:075-753-2094
E-mail:comms◎mail2.adm.kyoto-u.ac.jp
補足
(注1) アデノシン三リン酸(adenosine triphosphate, ATP)
全ての生物がエネルギー源として利用している、生物が生きるために必須な生体物質
(注2) 出芽酵母 (budding yeast, 学名:Saccharomyces cerevisiae)
直径約5 µmの単細胞性の酵母、遺伝子操作が極めて容易に行えるため真核細胞研究におけるモデル細胞として広く利用されている
(注3)2019年に発表した先行研究
(注4) タンパク質凝集体(protein aggregates)
正常なタンパク質は自発的に折りたたまれ固有の3次元構造を取っているが、熱やpHの変化等のストレスによりその構造が取れなくなると無秩序に会合して凝集体と呼ばれる塊を作る、凝集体は元のタンパク質の機能を失っており、しばしば細胞に対して毒性を発揮する
(注5) 神経変性疾患(neurodegenerative disease)
特定の神経細胞の構造や機能が徐々に損失し、認知機能や運動機能に障害をきたす疾患、詳細な発症メカニズムは未だ不明であるが、多くの場合、疾患特有のタンパク質が神経細胞内外に異常な凝集体を形成して毒性を持つことが知られている、例)アルツハイマー病/アミロイドβ, タウタンパク質; パーキンソン病/α-シヌクレイン; ハンチントン病/ハンチンチン
